Как работают батарейки и аккумуляторы
Для каждого нового опыта с бутылками нам приходилось
переливать воду из правой в левую. Для чего? А для того, чтобы создать
разность уровней, чтобы возник ток воды в шланге. Постепенно вода
перетекала из левой бутылки в правую, уровни сравнивались и ток
прекращался. Мы снова переливали воду, и процесс начинался заново.
Значит, идея такова: чтобы ток воды не прекращался, надо постоянно
поддерживать разность уровней воды.
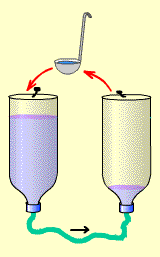
Попробуем! Для этого надо взять какой-нибудь черпачок,
например - кофейную чашечку. Этим черпачком мы будем вычерпывать воду
из правой бутылки, и выливать её в левую.
Причем надо вычерпывать с такой скоростью, чтобы количество
переливаемой воды было не меньше количества поступающей по шлангу за то
же время. Иначе, если отчерпывать меньше, чем за то же время
переливается по шлангу - через некоторое время уровни все равно
сравняются и ток прекратится.
Переходим к электричеству.
Итак, у нас есть две заряженные гайки от трактора Беларусь. Или лучше,
давайте возьмем просто две металлические пластины. Потенциал одной - 10
В, другой - 15 В. Между ними напряжение - 5В. Подключаем к ним
лампочку. Лампочка светится, ток идет. Идет, идет, идет? И вот уже не
идет, и лампочка не горит! Почему? А потому что ток уровнял потенциалы
двух пластин, и напряжение между ними стало 0В.
Чтобы лампочка загорелась снова, надо что? Надо перенести заряд с одной
пластины на другую и тем самым снова создать разность потенциалов. Для
этого надо привлечь к работе какие-то сторонние силы, которые бы
занялись перекачкой зарядов. В опыте с бутылками этой сторонней силой
являлся тот, кто вычерпывал воду. В электротехнике такой силой может
служить, например, химическая реакция.
Любая батарейка или аккумулятор - это ни что иное, как две
металлические пластины, помещенные в специальное химическое вещество -
электролит. Одна пластина подключена к выводу "+", другая - к выводу
"-". Допустим, батарейка рассчитана на 9 Вольт. Пока ее не трогают,
напряжение между пластинами остается равным 9В. Но стоит подключить к
батарейке нагрузку, например, лампочку, как от пластины "+" к пластине
"-" потечет ток. Напряжение начнет уменьшаться. И тут же "включится"
химическая реакция в электролите, которая начнет перекидывать электроны
с "-" (отрицательной) пластины обратно на положительную, поддерживая
тем самым разность потенциалов между ними. Чем больше сила тока в
нагрузке (чем больше мощность лампочки), тем интенсивнее будет
протекать реакция.
Все реакции можно делить на две большие группы: те, в
результате которых выделяется энергия, и те, для проведения которых
необходима энергия извне. Реакция внутри батарейки относится к первому
типу. К этому же типу относится реакция горения.
При горении, в результате соединения молекулы топлива с кислородом,
выделяется энергия в виде тепла и света, и образуется новое вещество -
окисленное топливо. Например, если топливом является уголь (состоящий,
в-основном, из углерода) - при соединении с воздухом получается оксид
углерода (углекислый газ). Углекислый газ не горит, и его мы больше
использовать не можем. То есть - он является отходом, бесполезным
продуктом реакции. По мере горения, количество исходных веществ
(топлива и кислорода) уменьшается, а количество бесполезного продукта
(углекислого газа) увеличивается. В конечном итоге, наступает момент,
когда продукты реакции сгорают полностью, и реакция прекращается.
В электролите тоже протекает реакция, в ходе которой
выделяется энергия в виде электрического тока. При этом, расходуются
исходные вещества, и выделяется бесполезный продукт. Чем меньше
остается расходных веществ - тем тяжелее батарейке поддерживать нужное
напряжение между пластинами. Батарейка "садится".
Мы уже делили все реакции на два вида. Поделим еще раз, но по-другому.
Реакции бывают обратимыми и необратимыми.
Если продукт реакции можно снова преобразовать в
исходные вещества - то такая реакция обратима. То есть, она идет "в обе
стороны".
Если в результате реакции получается продукт, который нельзя преобразовать обратно, то реакция необратима.
"Фарш невозможно провернуть назад
И мясо из котлет не восстановишь?"
Чем отличается батарейка от аккумулятора? Тем что батарейку нельзя
заряжать, а аккумулятор - можно. То есть, в батарейке протекает
необратимая реакция, а в аккумуляторе - обратимая. Когда мы подключаем
аккумулятор к зарядному устройству, ток внутри него начинает течь в
обратном направлении, то есть - от "+" к "-". И реакция в электролите
также начинает идти в обратном направлении. В результате, продукт
реакции разлагается на исходные вещества. Аккумулятор "заряжается"
Пожалуй, это все о батарейках и аккумуляторах.
Источник: Радио Кот

